美國FDA出臺更嚴格新冠疫苗加強針審批標準 健康人群需提供更強證據
快訊
2025年05月21日 06:30 30
admin
美國食品藥品監督管理局(FDA)周二發布新版新冠疫苗加強針監管指南,對健康人群設定了更嚴格的審批標準。根據發表在《新英格蘭醫學雜志》的指導文件,FDA將依據患者重癥風險實施分級證據標準。該文件由FDA局長馬蒂·馬卡里(Marty Makary)與疫苗監管負責人維奈·普拉薩德(Vinay Prasad)共同撰寫,后者是以批評制藥業著稱的學者。
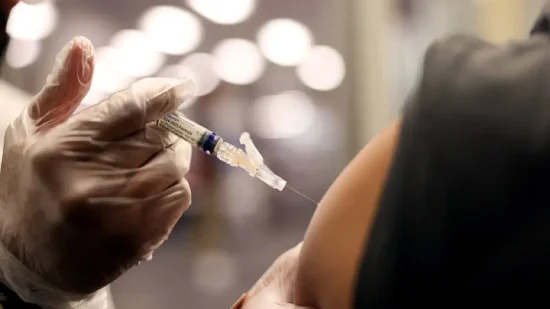
這一政策調整正值衛生與公眾服務部部長小羅伯特·F·肯尼迪(Robert F. Kennedy Jr.)——著名的疫苗懷疑論者——全面改革國家衛生機構之際。
對于65歲及以上老年人,以及6個月以上存在特定基礎疾病的患者,FDA表示可接受免疫原性數據(證明疫苗能激發足夠抗體反應)作為獲益大于風險的判定依據。但對6個月至64歲無風險因素的健康人群,該機構要求必須提供隨機對照試驗的臨床終點證據,包括降低感染率或住院率等實際療效數據方可獲批。
高風險人群疫苗獲批時,FDA將要求藥企承諾開展健康成人隨機對照試驗作為上市后研究。此前FDA主要依賴免疫原性數據審批針對新流行毒株的年度加強針,這種模式與流感疫苗審批機制類似。
“新政策體現了監管靈活性與科學嚴謹性的平衡,”FDA在文件中表示,“既確保高風險人群及時獲得疫苗,又要求提供健康人群的黃金標準數據。”馬卡里與普拉薩德將于美東時間周二下午1點通過線上會議闡釋新框架。
相關文章





最新評論